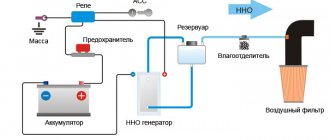
Обеззараживание воды прямым электролизом
Что такое прямой электролиз воды?
Прохождение электрического тока через обрабатываемую воду сопровождается серией электрохимических реакций, в результате которых в воде образуются новые вещества, и изменяется структура межмолекулярных взаимодействий. При прямом электролизе воды происходит синтез окислителей – кислорода, озона, перекиси водорода и др. Кроме этого в воде даже с очень низким содержанием хлоридов при прямом электролизе образуется остаточный хлор, что очень важно для пролонгированного эффекта обеззараживания воды.
Теория процесса электролиза воды
В упрощенном виде прямой электролиз воды состоит из нескольких процессов.
1) Электрохимический процесс.
В воде (H2O) расположены параллельно две пластины (электроды): анод и катод. Напряжение постоянного тока, подаваемое на электроды, приводит к электролизу воды.
На аноде производится кислород: 2H2O → O2 + 4H+ + 4e− (вода подкисляется).
На катоде образуется водород: 2H2O + 2e− → H2 + 2OH− (вода подщелачивается).
Количество выделяющегося водорода незначительно и не является большой проблемой.
Использование специальных электродов позволяет производить из воды озон и перекись водорода.
На аноде производится озон: 3H2O → O3 + 6e− + 6H+ (вода подкисляется).
На катоде – перекись водорода: O2 + 2H2O + 2e− → H2O2 + 2OH− (вода подщелачивается).
Естественная пресная (не дистиллированная) вода всегда содержит минеральные соли – сульфаты, карбонаты, хлориды. В целях получения хлора для пролонгированного эффекта обеззараживания воды интересны только хлориды. В воде они представлены в основном хлоридом натрия (NaCl), хлоридом кальция (CaCl) и хлоридом калия (KCl).
На примере с хлоридом натрия реакция образования хлора электролизом будет следующей.
Соль, растворенная в воде: 2NaCl + H2O → 2Na+ +2Cl– + 2H2O
Во время электролиза на аноде формируется хлор: 2Cl– → Cl2+2e– (вода подкисляется).
А у катода образуется гидроокись натрия: Na+ + OH– → NaOH (вода подщелачивается).
Эта реакция является недолгой, поскольку любой хлор, произведенный у анода, быстро потребляется для формирования гипохлорита натрия: Cl2 + 2NaOH → H2 + 2NaOCl.
Подобные реакции электролиза происходят и с хлоридами кальция и калия.
Таким образом, в результате электролиза пресной воды генерируется смесь сильных окислителей: кислород + озон + перекись водорода + гипохлорит натрия.
2) Электромагнитный процесс.
Молекула воды представляет собой маленький диполь, содержащий положительный (со стороны водорода) и отрицательный (со стороны кислорода) заряды на полюсах. В электромагнитном поле водородная часть молекулы воды притягивается к катоду, а кислородная часть к аноду. Это приводит к ослаблению и даже разрыву водородных связей в молекуле воды. Ослабление водородных связей способствует образованию атомарного кислорода. Наличие в воде атомарного кислорода способствует уменьшению жесткости воды. В обычной воде всегда присутствует кальций. Ионы Са+ окисляются атомарным кислородом: Са+ + О → СаО. Окись кальция, соединяясь с водой, образует гидрат окиси кальция: СаО + Н2О → Са(ОН)2. Гидрат окиси кальция – сильное основание, хорошо растворимое в воде. Аналогичные процессы происходят и с другими элементами жесткости воды.
3) Процессы кавитации.
В результате электрохимического и электромагнитного процесса происходит образование микроскопических газовых пузырьков кислорода и водорода. Вблизи поверхности электродов появляется белесое облачко, состоящее из возникших пузырьков. Увлекаемые потоком воды, пузырьки смещаются в область, где скорость потока меньше, а давление выше, и происходит их схлопывание с большой скоростью.
Мгновенное схлопывание пузырька высвобождает огромную энергию, которая разрушает водную стенку пузырька, т.е. молекулы воды. Следствием разрушения молекулы воды является образование ионов водорода и кислорода, атомарных частиц водорода и кислорода, молекул водорода и кислорода, гидроксилов и других веществ.
Перечисленные процессы способствуют образованию основного окислителя – атомарного кислорода.
В чём уникальность прямого электролиза воды?
Обеззараживание воды прямым электролизом является разновидностью окислительной обработки воды, но кардинально отличается от распространенных методов обеззараживания тем, что окислители производятся из самой воды, а не вносятся извне и, выполнив свою функцию, переходят в прежнее состояние. Эффективность обеззараживания воды прямым электролизом в несколько раз выше по сравнению с химическими методами. Прямой электролиз воды способствует удалению цветности, сероводорода, аммония исходной воды. Для прямого электролиза не требуются дозирующие насосы и использование реагентов.
Хлор, необходимый для предотвращения вторичного бактериального загрязнения воды в распределительных сетях, активируется из естественных минеральных солей в воде, проходящей через электролизёр, и моментально растворяется в ней. Прямой электролиз разрушает хлорамины, преобразуя их в азот и соль.
Источник
Поделитесь в соц сетях:
Рекомендуем так же почитать:
Антиоксиданты. Эффект оказываемый антиоксидантами
Как подобрать ионизатор воды?
Щелочная — водородная вода
Последние статьи в блоге
Технологии хранения щелочной воды Чистка камеры ионизатора воды FUJIIRYOKI Прямой электролиз — это важно знать! Полное понимание о пластинах в ионизаторах воды Важно ли количество пластин в ионизаторах воды?
Очистка воды электролизом
27.08.2020
Вопрос о качестве воды, текущей из наших кранов, становится все актуальней с развитием промышленности в городах. Ведь её чистота и качество неразрывно связаны с нашим здоровьем. За год человек в среднем выпивает около 750 литров воды, он состоит из неё на 70%. Вода выполняет множество функций в нашем организме: обмен веществ, вывод накопившихся токсинов и продуктов распада, поддержание теплового баланса. Обезвоживание организма более опасно, чем недостаток пищи.
Вода из крана в лучшем случае подходит для купания в ванной и мытья посуды. Она содержит массу примесей: ржавчину, тяжелые металлы, химические примеси, соли кальция и магния и самые различные вещества класса канцерогенных химических соединений. Примеси попадают в водоём питьевой воды со сточными и грунтовыми водами и просто из старых ржавых водопроводов. Водоочистка — это процесс устранения загрязняющих примесей из воды, в большинстве случаев очистку производят, чтоб сделать воду пригодной для питья. Для того чтобы продемонстрировать всю грязь, которая содержится в водопроводной воде и которую мы пьем, достаточно провести процесс очистки воды электролизом в одном стакане воды, взятой из крана. Впечатляющее зрелище — кристально чистая на вид вода из крана за какое-то мгновение становится мутной и грязной, невооруженным глазом заметен слоистый зелено-коричневый осадок, падающий слоями на дно стакана. Любой наблюдатель процесса водоочистки сразу невольно задумается о здоровье внутренних органов, камнях в почках, иммунной системе и многом другом.
Решения BWT для промышленной и бытовой очистки воды:
Фильтры механической очистки
Фильтр с активированным углем
Удаление железа и марганца
Фильтры под мойку
Получить консультацию
Очистка воды электролизом
представляет собой физико-химический процесс. Он заключается в выделении на электродах различных составных частей веществ, растворенных в воде. Процедура очистки воды электролизом возникает при пропускании через раствор или расплав электролита электрического разряда. Анодом в химии называется положительный электрод, катодом — отрицательный. Положительные ионы — (катионы) — начинают движение к катоду, отрицательные ионы — (анионы) — стремятся к аноду. Суть процесса в следующем: в электрическом поле, созданном соединенными с источником электрической энергии электродами, возникает упорядоченное движение ионов. Для возникновения процесса необходимо лишь поместить устройство в проводящую жидкость – воду. Электролиз воды — это сложный электролитический процесс доочистки водопроводной воды, при котором с помощью электрического тока вода распадается на составляющие — кислород и водород, иногда для этого процесса используется шестивольтная батарея. Ячейка электролиза состоит из двух электродов. Их присоединяют к противоположным полюсам источника электрической энергии. Первые примеры применения электролиза описаны в истории и датированы примерно 300 столетием до н.э.
Широкое применение процесса электролиза очистки воды
обусловлено его эффективностью. Результатом такой водоподготовки является разрушение органических веществ в воде и извлечение металлов, кислот, неорганических веществ и примесей. Электролитическая очистка осуществляется с помощью специальных устройств — электролизеров. Стоит отметить, что обычный гидравлический насос – простой приборчик элементарного электролиза воды из крана.
Поскольку очистка воды электролизом основана на способности веществ распадаться под действием электрического тока, то использование этого метода имеет ряд преимуществ, главное из которых — высокая степень очистки, позволяющая передавать очищенную воду на коммунальные сооружения, также следует отметить, что вещества (СО2, Н2, О2), образующиеся при распаде воды, оказывают гораздо меньшее воздействие на окружающую среду, чем содержащиеся в исходной воде. К недостаткам этого метода можно отнести повышенный расход электроэнергии. Сегодня представляет интерес использование этого метода для локальной очистки водоемов, содержащих роданид, тиосульфат и сульфат натрия с высокой концентрацией загрязняющих примесей. В настоящее время установки для очистки воды электролизом
разрабатываются повсеместно, ведутся исследования этого перспективного метода, который в дальнейшем позволит устранить ряд важных проблем, связанных со здоровьем человека и защитой окружающей среды.
Электролиз воды. Как происходит процесс и зачем он нужен
Электролизом называется особый физико-химический процесс, при котором жидкость или, иначе говоря, электролит, распадается на положительные и отрицательные ионы. Происходит это под воздействием электрического тока. Каким же образом протекает данный процесс?
Электролиз воды происходит из-за того, что электрический ток, проходя через электролит, вызывает реакцию на электродах, на которых и оседают положительные и отрицательные ионы. На отрицательно заряженном электроде (катоде) оседают катионы, соответственно, на положительном (аноде) – анионы. Электролит может состоять из воды, в которую добавлена кислота или же представляет собой раствор солей. Распад солей на металл и кислотный остаток возникает после того, как через электролит пропускается электрический ток. Заряженный положительным электричеством металл подходит к катоду (отрицательно заряженному электроду), именно этот металл и называется катионом. Кислотный остаток, отрицательно заряженный, стремится к аноду (положительно заряженному электроду), и называется анионом. Электролиз дает возможность получения из солей хорошо очищенных элементов, благодаря чему находит широкое применение в разнообразных отраслях современной промышленности.
Электролиз воды жизненно необходим сегодня, когда тысячи предприятий применяют воду для отдельных этапов своего производства. Объясняется это тем, что после большинства процессов, которые выполняются на предприятиях, вода после использования превращается в опасную для людей и живой природы жидкость. Электролиз воды служит для очистки сточных вод, которые не должны попадать в землю или же в источники чистой воды. Эти сточные воды необходимо очищать для того, чтобы не допустить экологическую катастрофу, риск которой и так уже достаточно высокий во многих регионах России.
Сегодня существует несколько методов электролиза воды. К ним относится электроэкстракция, электрокоагуляция и электрофлотация. Электролиз воды, применяемый для очистки сточных вод, производится в электролизерах. Это специальные сооружения, в которых органические вещества разлагаются на металлы, кислоты и другие вещества, относящиеся к категории неорганического происхождения. Особенно важно проводить очистку сточных вод на вредных производствах, таких как предприятия химической промышленности, там, где ведутся работы с медью и свинцом, а также на комбинатах, выпускающих краски, лаки, эмали. Безусловно, это далеко не дешевый способ очистки воды при помощи электролиза, но затраты, связанные с очисткой воды, не идут ни в какие сравнения со здоровьем человека и заботой об окружающей среде.
Интересный факт, но можно осуществить электролиз воды в домашних условиях. Этот процесс не займет много времени и средств и даст возможность для получения кислорода и водорода. В емкость с водой, в которой предварительно растворена соль, (соли необходимо взять не менее ¼ объема воды), опускаются два электрода. Их можно сделать из любого металла. Электроды подключаются к источнику питания с силой тока не менее 0,5 А. На одном из электродов образуются пузыри, что и говорит о том, что электролиз воды в домашних условиях проходит успешно. Данным способом можно получить едкий натрий, хлор и другие химические элементы, в зависимости от того, из чего состоит электролит. Плазменный электролиз воды применяют в плазмотеплолизерах. Это новейшее современное устройство, работающее в режимах плазменного электролиза воды и ее непосредственного нагрева до определенных температур. Плазменный электролиз воды дает возможность для получения новых видов энергии, в которой с каждым днем все больше нуждается человечество. Энергия, которую можно будет получать из воды, даст возможность для создания новых, безопасных и эффективных видов источников энергии. Явления плазменного электролиза воды еще не изучены до конца, но они имеют огромные перспективы и поэтому интенсивно изучаются современными учеными.